পারমাণবিক সংখ্যা ও ভর সংখ্যার মধ্যে পার্থক্য নিয়ে জানার চেষ্টা করবো আমরা কিছু বাস্তব উদাহরণের মাধ্যমে।
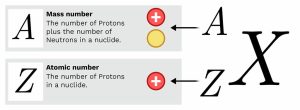
পারমাণবিক সংখ্যা
কোন মৌলের একটি পরমাণুর নিউক্লিয়াসে যতটি প্রোটন থাকে, প্রোটনের সে সংখ্যাকে ঐ মৌলের পারমাণবিক সংখ্যা বা প্রোটন সংখ্যা বলা হয়। প্রোটন সংখ্যাকে সাধারণত Z দ্বারা প্রকাশ করা হয়। যেমন, সোডিয়াম পরমাণুর নিউক্লিয়াসে 11টি প্রোটন আছে। তাই সোডিয়ামের পারমাণবিক সংখ্যা হল Z = 11। তেমনি ক্লোরিনের পারমাণবিক সংখ্যা হল Z = 17। মৌলের ধর্ম এর পারমাণবিক সংখ্যার উপর নির্ভর করে। রাসায়নিক বিক্রিয়ার সময় পরমাণুর সর্ববহিস্থ শক্তিস্তরের ইলেকট্রনসমূহ অংশগ্রহণ করে এবং ইলেকট্রনের সংখ্যার পরিবর্তন ঘটে, কিন্তু প্রোটন সংখ্যা বা পারমাণবিক সংখ্যার কোন পরিবর্তন ঘটে না।
পারমাণবিক ভর সংখ্যা
কোন পরমাণুর ভর মূলত এর নিউক্লিয়াসে পুঞ্জীভূত থাকে। নিউক্লিয়াসে প্রোটন ও নিউট্রন থাকে বলে এদেরকে একত্রে নিউক্লিয়ন (nucleon) বলে। কোন মৌলের পরমাণুর প্রোটন ও নিউট্রনের মোট সংখ্যাকে নিউক্লিয়ন সংখ্যা বা পারমাণবিক ভর সংখ্যা বা মাস-সংখ্যা বলা হয়।
নিউক্লিয়ন সংখ্যাকে A দ্বারা প্রকাশ করা হয়। কোন পরমাণুর নিউক্লিয়াসে প্রোটন ও নিউট্রন সংখ্যা যথাক্রমে p ও n হলে, তখন ঐ মৌলের পারমাণবিক ভর সংখ্যা, A = (p+n) হবে। যেমন, কার্বনের পরমাণুতে প্রোটন সংখ্যা হল 6 ও নিউট্রন সংখ্যা হল 6। তাই কার্বনের পারমাণবিক ভর সংখ্যা, A = 6 + 6 = 12
পারমাণবিক সংখ্যা, ভর সংখ্যা, চার্জ ও পরমাণু সংখ্যা লেখার নিয়ম
কোন মৌলের পারমাণবিক সংখ্যা (Z)-কে প্রতীকের বাম পার্শ্বের নিচে, মৌলের ভর সংখ্যা (A)-কে প্রতীকের বাম পার্শ্বের উপর দিকে লেখা হয়। এছাড়া অণুস্থিত পরমাণুর সংখ্যা (n)-কে প্রতীকের ডান পার্শ্বের নিচে, আয়নের চার্জ সংখ্যা (m+-) কে প্রতীকের ডান পার্শ্বের উপরদিকে লেখা হয়। কোন মৌলের প্রতীককে X ধরে উপরিউক্ত সব নিয়মকে নিম্নমতে লেখা হয়। যেমন-
আশাকরি, পারমাণবিক সংখ্যা ও ভর সংখ্যার মধ্যে পার্থক্য নিয়ে আর কোনো কনফিউশান থাকবে না তোমাদের।
