অ্যামাগার পরীক্ষার থেকে জানা যায় যে, বাস্তব গ্যাস গুলো আদর্শ আচরণ থেকে বিচ্যুতি দেখায়। আদর্শ আচরণ থেকে বাস্তব গ্যাসের বিচ্যুতির ব্যাখ্যা পেষণ গুণাঙ্ক (Z) দ্বারা ব্যাখ্যা করা হয়। বাস্তব গ্যাসের পেষণ গুণাঙ্ক আদর্শ গ্যাস সমীকরণের সাথে যে সম্পর্ক তৈরি করে তা হচ্ছে-
PV = ZnRT
or, পেষণ গুণাঙ্ক Z = PV / nRT
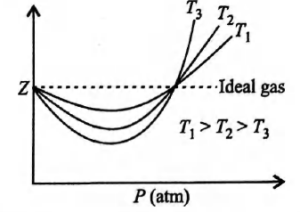
- এক মোল আদর্শ গ্যাসের বেলায় Z = 1 হয়। Z এর মান P ও T এর উপর নির্ভরশীল। Z এর মান 1 থেকে যত বেশি বা কম হবে, বাস্তব গ্যাসটি আদর্শ আচরণ থেকে ততই বিচ্যুত হবে।
- যখন Z > 1 হয়, তখন গ্যাসটি আদর্শ গ্যাস অপেক্ষা কম পেষণ যোগ্য হয়। যেমন- H2, He, N2 ইত্যাদি।
- যখন Z < 1 হয়, তখন গ্যাসটি আদর্শ গ্যাস থেকে বেশি পেষণ যোগ্য হয়। যেমন- CO2, O2 ইত্যাদি। এ সব গ্যাস পানিতে অধিক দ্রবণীয়।
পেষণ গুণাঙ্ক (Z) বনাম চাপ (P) লেখচিত্র থেকে জানা যায়, শূন্য চাপের নিকটে Z = 1 হয়, অর্থাৎ অতি কমচাপে সব বাস্তব গ্যাস আদর্শ আচরণ করে।
আবার তাপমাত্রা বাড়ালে লেখের বক্রতা কমে গিয়ে লেখগুলো আদর্শ গ্যাসের লেখের নিকটবর্তী হতে থাকে। যে তাপমাত্রায় বাস্তব গ্যাস আদর্শ আচরণ করে, তাকে বয়েলের তাপমাত্রা বলে।
