পরমাণু মৌলিক পদার্থের ক্ষুদ্রতম কণা, সাধারণত যার স্বাধীন অস্তিত্ব নেই, কিন্তু ক্ষুদ্রতম একক রূপে সরাসরি রাসায়নিক বিক্রিয়ায় অংশগ্রহণ করতে পারে, তাকে পরমাণু বলে। পরমাণুর মূল কণিকা কয়টি সেটা নিয়ে এখানে জানবো আমরা। প্রত্যেক মৌলের প্রতীক দ্বারা ঐ মৌলের পরমাণুকে বোঝানো হয়। যেমন, H দ্বারা হাইড্রোজেনের পরমাণু বোঝায়। পরমাণুসমূহকে বিভিন্নভাবে ভেঙে যে সব কণা আবিষ্কৃত হয়েছে মোটামুটিভাবে তাদেরকে পরমাণুর মূল কণিকা বলা হয়। অবশ্য অন্যভাবেও কিছু কিছু কণা সৃষ্টি সম্ভব হয়েছে। তাদের সংখ্যা প্রায় ২০০-এর মত এবং এ সংখ্যা আরও বাড়ছে। মূল কণিকার সংজ্ঞা নিম্নরূপ-
মূল উপাদানরূপে যে সব অতি সূক্ষ্ম কণিকা দ্বারা পরমাণু গঠিত, তাদেরকে পরমাণুর হয়। মূল কণিকা দু প্রকার, যথা- (১) স্থায়ী মূল কণিকা ও (২) অস্থায়ী মূল কণিকা।
স্থায়ী মূল কণিকা : যে সব মূল কণিকা সব মৌলের পরমাণুতে থাকে, তাদেরকে স্থায়ী মূল স্থায়ী মূল কণিকা বলে। এরা তিন ধরনের- ইলেকট্রন, প্রোটন ও নিউটন।
অস্থায়ী মূল কণিকা : যে সব মূল কণিকা কোন কোন মৌলের পরমাণুতে খুবই অল্প সময়ের জন্য অস্থায়ীভাবে থাকে, তাদেরকে অস্থায়ী মূল কণিকা বলে। অস্থায়ী মূল কণিকার কয়েকটি হচ্ছে- (১) পাইওন, (২) মিউওন, (৩) নিউট্রিনো ও (৪) মেসন প্রভৃতি। অস্থায়ী মূল কণিকাগুলো সৃষ্টির সঙ্গে সঙ্গে অন্য কণিকায় পরিণত হয়।
কম্পোজিট কণিকা (Composite Particle) : স্থায়ী মূল কণিকা ও অস্থায়ী মূল কণিকা ব্যতীত আরও এক শ্রেণীর ভারী কণিকা বিভিন্ন পরমাণু থেকে পাওয়া যায়, এদেরকে যৌগিক কণা বা কম্পোজিট কণিকা বলে। যেমন- (১) আলফা কণিকা (২) ডিউটেরন কণা।
তিনটি স্থায়ী মূল কণিকা
ইলেকট্রন (Electron)
১৮৯৭ খ্রিস্টাব্দে স্যার জে. জে. থমসন (Sir. J. J. Thomson) ক্যাথোড রশ্মির উপর পরীক্ষার সময় ইলেকট্রনের অস্তিত্ব আবিষ্কার করেন। সব প্রকার পরমাণুতে কম-বেশি ইলেকট্রন বিদ্যমান। পদার্থের মধ্যে ইলেকট্রন সর্বাপেক্ষা ক্ষুদ্রতম কণা। একটি ইলেকট্রনের ভর হচ্ছে 9.1085 × 10^-28 g যা একটি প্রোটনের ভরের প্রায় 1837 এর সমান। ইলেকটন ঋণাত্মক চার্জযুক্ত এবং ঋণাত্মক চার্জের পরিমাণ = 1.6 × 10^-19 C (কুলম্ব)। এর চেয়ে কম চার্জ দেখা যায় না। তাই এই পরিমাণ চার্জকে বৈদ্যুতিক ঋণাত্মক চার্জের একক ধরা হয়। অর্থাৎ প্রতিটি ইলেকট্রনে এক একক ঋণাত্মক বৈদ্যুতিক চার্জ আছে। ইলেকট্রনকে ‘e’ প্রতীক দ্বারা বোঝানো হয়। ইলেকট্রন পরমাণুর নিউক্লিয়াসের বাইরে অবস্থান করে।
প্রোটন (Proton)
১৯১৯ খ্রিস্টাব্দে বিজ্ঞানী রাদারফোর্ড ইলেকট্রনের মত প্রোটনও সব পদার্থের পরমাণুর একটি সাধারণ উপাদান- এ তথ্য সর্বপ্রথম প্রমাণ করেন। প্রোটন পরমাণুর নিউক্লিয়াসে বিদ্যমান সর্বাপেক্ষা হাল্কা ধনাত্মক চার্জবিশিষ্ট একটি স্থায়ী বস্তু কণিকা। প্রোটনের ভর 1.673 x 10^-24 g যা হাইড্রোজেনের পরমাণুর ভরের প্রায় সমান। পারমাণবিক ভর স্কেলে এর পরিমাণ 1.007276 amu. প্রোটন হচ্ছে প্রকৃতপক্ষে H+ অর্থাৎ একটি হাইড্রোজেন পরমাণু থেকে একটি ইলেকট্রন সরিয়ে নিলেই প্রোটন পাওয়া যায়। সুতরাং প্রোটনের বৈদ্যুতিক চার্জের পরিমাণ ইলেকট্রনের সমান, কিন্তু তা ধনাত্মক। এর পরিমাণও +1.6 x 10^-19 C যা ধনাত্মক চার্জের এক একক। প্রোটনের প্রতীক হচ্ছে p। প্রোটন নিউক্লিয়াসে থাকে।
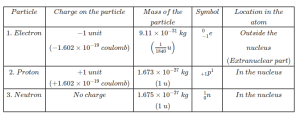
নিউট্রন (Neutron)
ইলেকট্রন ও প্রোটনের মত নিউট্রনও একটি মৌলিক কণিকা। ১৯৩২ খ্রিস্টাব্দে বিজ্ঞানী জেমস চ্যাডউইক সর্বপ্রথম নিউটন সম্মন্ধে ধারণা দেন এবং সিদ্ধান্তে উপনীত হন যে, হাইড্রোজেন-1 ব্যতীত অন্য যে কোন পরমাণুর অভ্যন্তরে নিউট্রন বিদ্যমান। নিউট্রনের ভর 1.675 × 10^-24 gm যা ইলেকট্রনের ভরের 1839 গুণ। পারমাণবিক ভর স্কেলে এর পরিমাণ 1.008665 amu. নিউট্রনের কোন বৈদ্যুতিক চার্জ নেই, অর্থাৎ এটি তড়িৎ নিরপেক্ষ। নিউটনের প্রতীক হচ্ছে n। এটি পরমাণুর কেন্দ্র নিউক্লিয়াসে অবস্থান করে। পরমাণুর মূল কণিকা কয়টি এর উত্তর হচ্ছে তিনটি।
