অরবিটাল কাকে বলে সেটা নিয়ে জানার চেষ্টা করবো এখানে। বোর পরমাণু মডেল অনুসারে পরমাণুর নিউক্লিয়াসের চারদিকে ইলেকট্রনসমূহ আবর্তনের জন্য কতগুলো বৃত্তাকার স্থির কক্ষপথ বা শক্তিস্তর আছে। এ সব বৃত্তাকার স্থির শক্তিস্তরকে অরবিট বলা হয়। এই শক্তিস্তরে আবার কিছু ভাগ থাকে। এদেরকে উপশক্তিস্তর বলে। উপশক্তিস্তর বলতে বোঝায় একটা পরমাণুতে ইলেকট্রন কোন আকৃতির পথ ধরে চলাচল করে সেটিকে। কোয়ান্টাম বলবিদ্যা অনুসারে ইলেকট্রন নিউক্লিয়াসের কাছেও থাকতে পারে, আবার নিউক্লিয়াস থেকে দূরেও থাকতে পারে। তবে নিউক্লিয়াসের চারদিকে যে এলাকায় আবর্তনশীল ও নির্দিষ্ট শক্তিযুক্ত ইলেকট্রন মেঘের অবস্থানের সম্ভাবনা 90-95% হয়ে থাকে, ইলেকট্রন মেঘের সে এলাকাকে অরবিটাল বলা হয়। প্রকৃতপক্ষে, অরবিটাল হল তরঙ্গ ফাংশন অর্থাৎ তরঙ্গ বলবিদ্যায় গাণিতিক ফাংশন, যা দ্বারা কোন পরমাণুতে ইলেকট্রনের অবস্থা বর্ণনা করা যায়।
পরমাণুতে বিভিন্ন উপশক্তিস্তরে ইলেকট্রনের থাকার সম্ভাব্য জায়গা গুলোকে অরবিটাল বলে।
অরবিটালের ধারণা
উপশক্তিস্তরকে l দিয়ে প্রকাশ করা হয়, এর মান-
l = 0 থেকে (n – 1) পর্যন্ত
তাই, n = 1 হলে l = 0 হয়
n = 2 হলে l = 0, 1 হয়
আবার, n = 3 হলে l = 0, 1, 2 হয়
n = 4 হলে l = 0, 1, 2, 3 হয়
উপশক্তিস্তর গুলোর মানের ক্ষেত্রে অরবিটাল ব্যাপারটা কাজ করে, যেখানে-
l = 0 হলে তাকে s অরবিটাল বলে,
আবার, l = 1 হলে তাকে p অরবিটাল বলে,
l = 2 হলে তাকে d অরবিটাল বলে,
আবার, l = 3 হলে তাকে f অরবিটাল বলে।
তাই উপশক্তিস্তর এবং অরবিটাল কখনোই একই জিনিস না। অরবিটাল বলতে একটা ইলেকট্রন উপশক্তিস্তরে কোন পথ অনুসরণ করে চলবে সেটাকে বোঝায়। যেমন কিছু ইলেকট্রন আছে যারা বৃত্তাকার পথ ধরে চলে, কিছু ইলেকট্রন ডাম্বেলাকার পথ ধরে চলে। এই বিভিন্ন আকৃতির পথগুলোকে অরবিটাল বলে। তাহলে অরবিটাল কাকে বলে সেটা বোঝা গেলো!
অরবিটালে ইলেকট্রন সংখ্যা
শক্তিস্তর n = 1 হলে উপশক্তিস্তর l = 0 হয় যেখানে অরবিটাল থাকে ১টি = 1s
n = 2 হলে l = 0, 1 হয় যেখানে অরবিটাল সহ উপশক্তিস্তর থাকে ২টি = 2s, 2p
আবার, n = 3 হলে l = 0, 1, 2 হয় যেখানে অরবিটাল সহ উপশক্তিস্তর থাকে ৩টি = 3s, 3p, 3d
n = 4 হলে l = 0, 1, 2, 3 হয় যেখানে অরবিটাল সহ উপশক্তিস্তর থাকে ৪টি = 4s, 4p, 4d, 4f
ভালো করে মনে রাখতে হবে,
প্রতিটা উপশক্তিস্তরে ইলেকট্রন সংখ্যা = 2 (2l + 1)
এবং s, p, d, f অরবিটালের জন্য-
s অরবিটালের আকৃতি মত পথ অনুসরণ করে সর্বোচ্চ 2টা ইলেকট্রন ঘোরে,
p অরবিটালের আকৃতি মত পথ অনুসরণ করে সর্বোচ্চ 6টা ইলেক্ট্রন ঘোরে,
d অরবিটালের আকৃতি মত পথ অনুসরণ করে সর্বোচ্চ 10টা ইলেক্ট্রন ঘোরে,
f অরবিটালের আকৃতি মত পথ অনুসরণ করে সর্বোচ্চ 14টা ইলেকট্রন ঘোরে।
সেইসাথে, 1s, 2s, 2p, 3s, 3p, 3d, 4s, 4p, 4d, 4f এদের দিয়ে উপশক্তিস্তর বোঝায় কিন্তু s, p, d, f দিয়ে কেবল অরবিটাল বোঝায়। তাহলে অরবিটাল কাকে বলে সেটা নিয়ে কিছুটা ধারণা পাওয়া গেলো।
বিভিন্ন অরবিটাল
s অরবিটাল
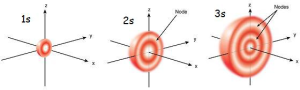
আমরা ইতোমধ্যে জেনে গেছি অরবিটাল কাকে বলে। এবার বিভিন্ন অরবিটাল সম্পর্কে জানবো। প্রধান কোয়ান্টাম সংখ্যা (n) এর যেকোন মানের জন্য s অরবিটাল (l = 0) এর ক্ষেত্রে m = 0 হয় বলে এর একটিমাত্র ত্রিমাত্রিক সমবিন্যাস সম্ভব। s অরবিটালের আকৃতি গোলকের ন্যায়, যার কেন্দ্রে নিউক্লিয়াস অবস্থিত। s অরবিটাল ত্রিমাত্রিকভাবে x অক্ষ, y অক্ষ ও z অক্ষ বরাবর সমভাবে বিস্তৃত থাকে। প্রধান কোয়ান্টাম সংখ্যা n এর মান যত বড় হবে, s অরবিটালের গোলকাকৃতিও তত বড় হবে।
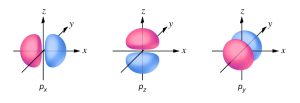
p অরবিটাল
পরমাণুর ইলেকট্রনের প্রথম শক্তিস্তরের জন্য প্রধান কোয়ান্টাম সংখ্যা n = 1 হয়, তখন সহকারী কোয়ান্টাম সংখ্যা, l = 0 হয়। অতএব প্রথম শক্তিস্তরে p অরবিটাল (l = 1) নেই। দ্বিতীয় শক্তিস্তরের জন্য n = 2 হয়। তখন l = 0, 1 দুটি মান হয়। l = 1 হলে p অরবিটাল হয়। আবার l = 1 হলে চৌম্বকীয় কোয়ান্টাম সংখ্যা, m = 1, 0, -1 তিনটি মান সম্ভব। অতএব একই শক্তিসম্পন্ন তিনটি করে অরবিটাল আছে, এদেরকে px, py, pz অরবিটাল বলা হয়। p অরবিটালসমূহের আকৃতি অনেকটা ডাম্বেলের (dumbel) ন্যায়। এদের আকৃতি একই প্রকারের হয়, কিন্তু এরা যথাক্রমে X, Y, Z অক্ষে পরস্পরের উপর লম্বভাবে থাকে এবং নিজ নিজ অক্ষ বরাবর দিক নির্দেশক রূপে বিস্তৃত থাকে। p-অরবিটালত্রয় s-অরবিটালের মত নিউক্লিয়াসের চতুর্দিকে সমভাবে বিস্তৃত থাকে না। পরমাণুর কেন্দ্রের দিকে ইলেকট্রন মেঘের ঘনত্ব কম এবং অক্ষ বরাবর ত্রিমাত্রিক স্থানে ইলেকট্রন মেঘের ঘনত্ব সর্বাধিক হয়।
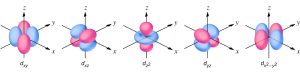
d অরবিটাল
কোন ইলেকট্রনের শক্তিস্তরের সহকারী কোয়ান্টাম সংখ্যা l = 2 হলে তখন এ অরবিটাল সম্ভব। যখন l = 2 হয়, তখন m এর মান পাঁচটি হয়- যেমন m = (2l + 1) = (2 * 2 + 1) = 5, এসব মান হল 2, 1, 0, -1, -2। তাই d অরবিটালের পাঁচ প্রকার ত্রিমাত্রিক বিন্যাস সম্ভব অর্থাৎ পাঁচটি সমশক্তির d অরবিটাল আছে। এদেরকে dxy, dyz, dzx, dx2-y2, dz2 অরবিটাল বলে। d অরবিটালের আকৃতি চারটি লোববিশিষ্ট ডাবল-ডাম্বেলের মত। প্রথম তিনটি দুটি অক্ষের মাঝখানে থাকে, যেমন dxy এর চারটি লোব X ও Y উভয় অক্ষের মাঝখানে, dyz এর চারটি লোব Yও Z উভয় অক্ষের মাঝখানে, dzx এর লোব Z ও X উভয় অক্ষের মাঝখানে অবস্থান করে। চতুর্থ অরবিটাল dx2-y2 এর চারটি লোব X ও Y অক্ষ বরাবর অবস্থান করে। পঞ্চম অরবিটাল dz2 এর মেঘপুঞ্জ চিত্রমতে Z-অক্ষ বরাবর এবং কিছু মেঘ চক্রাকারে X ও Y অক্ষদ্বয়ের ছেদবিন্দুকে কেন্দ্র করে অবস্থান নেয়।
তবে সবসময় মনে রাখা প্রয়োজন যে, সুবিধাজনকভাবে দ্বিমাত্রিকভাবে আঁকা হলেও এ সব অরবিটালের আকৃতি প্রকৃতপক্ষে ত্রিমাত্রিক। যেমন s অরবিটালের আকৃতি বৃত্তের ন্যায় নয় বরঞ্চ ফুটবলের ন্যায় গোলকাকার।
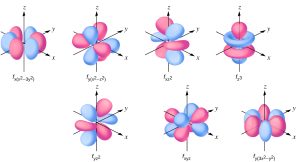
f অরবিটাল
f অরবিটালের আকার অত্যন্ত জটিল (s এর মতো গোলাকার বা p এর মতো ডাম্বেল নয়)। এটির বিভিন্ন আকার থাকতে পারে। সাধারণত ফুলের মতো বা জটিল লোবযুক্ত আকারের। ৭টি অরবিটাল প্রত্যেকটি ভিন্নভাবে স্থাপন থাকে। f অরবিটালের ইলেকট্রন ল্যান্থানাইড ও অ্যাকটিনাইড সিরিজের মৌলে গুরুত্বপূর্ণ। 4f অরবিটাল → ল্যান্থানাইড সিরিজে পূর্ণ হয়। 5f অরবিটাল → অ্যাকটিনাইড সিরিজে পূর্ণ হয়।