আইসোটোপের শতকরা পরিমাণ নির্ণয় করে কিভাবে সেটা নিয়ে জানবো এখানে। প্রকৃতিতে কোনো মৌলের যতগুলো আইসোটোপ শতকরা পরিমাণ আকারে পাওয়া যায়, সেখান থেকে ঐ মৌলের আপেক্ষিক পারমাণবিক ভর পাওয়া যায়। এর আরেক নাম হচ্ছে গড় আপেক্ষিক পারমাণবিক ভর। ধরা যাক, কোনো একটা মৌলের M1, M2, M3 এই তিনটি পারমাণবিক ভর যুক্ত আইসোটোপ প্রকৃতিতে যথাক্রমে a%, b% ও c% আকারে পাওয়া যায়। এখন ঐ মৌলের আপেক্ষিক পারমাণবিক ভর হবে-
(a M1 + b M2 + c M3) / 100
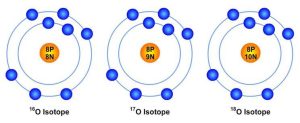
যেমন অক্সিজেনের ৩টা আইসোটোপ প্রকৃতিতে আছে-
16O – 99.76%
17O – 0.037%
18O – 0.204%
তাই অক্সিজেনের আপেক্ষিক পারমাণবিক ভর-
[(99.76 x 16) + (0.037 x 17) + (0.204 x 18)] / 100
= 16
আবার প্রকৃতিতে ক্লোরিনের ২টা আইসোটোপ আছে-
35Cl – 75%
37Cl – 25%
তাই ক্লোরিনের আপেক্ষিক পারমাণবিক ভর-
[(35 x 75) + (37 x 25)] / 100
= 35.5
আবার প্রকৃতিতে কার্বনের দুটো আইসোটোপ থাকে-
12C – 98.89%
13C – 1.11%
তাই কার্বনের আপেক্ষিক পারমাণবিক ভর-
[(98.89 x 12) + (1.11 x 13)] / 100
= 12
এই প্রসেস গুলো অনুসরণ করে আইসোটোপের শতকরা পরিমাণ নির্ণয় করা হয়।
