কোয়ান্টাম সংখ্যা কি সেটা নিয়ে জানার চেষ্টা করবো এখানে। কোয়ান্টাম বলবিদ্যা অনুসারে পরমাণুর ইলেকট্রনের কক্ষপথ বা শক্তিস্তরের আকার (size), কক্ষপথের আকৃতি (shape) ও কক্ষপথের ত্রিমাত্রিক দিক বিন্যাস (orientation) নির্দেশক পরস্পর সম্পর্কযুক্ত তিনটি রাশি রয়েছে। এছাড়া পারমাণবিক বর্ণালীর সূক্ষ্ম গঠন বিশ্লেষণের জন্য ইলেকট্রনের অক্ষ বরাবর ঘূর্ণন (spin) প্রকাশক চতুর্থ রাশি আছে। এ চারটি রাশিকে কোয়ান্টাম সংখ্যা বলা হয়। এ চারটি কোয়ান্টাম সংখ্যার নাম হল-
- প্রধান কোয়ান্টাম সংখ্যা, n (Principal quantum number)
- অ্যাজিমুথাল বা সহকারী কোয়ান্টাম সংখ্যা, (Azimuthal or subsidiary quantum number)
- চৌম্বকীয় কোয়ান্টাম সংখ্যা, m (Magnetic quantum number) ও
- ঘূর্ণন কোয়ান্টাম সংখ্যা, s (Spin quantum number)
কোয়ান্টাম সংখ্যার গুরুত্ব : কোয়ান্টাম সংখ্যা কি সেটা নিয়ে জানলাম আমরা। কোন পরমাণুতে প্রতিটি ইলেকট্রনের শক্তিস্তরের আকার, আকৃতি, ত্রিমাত্রিক দিক বিন্যাস ও অক্ষ বরাবর ইলেকট্রনগুলোর ঘূর্ণন সুষ্ঠুভাবে বর্ণনা করার জন্য চারটি কোয়ান্টাম সংখ্যা প্রয়োজন।
প্রধান কোয়ান্টাম সংখ্যা
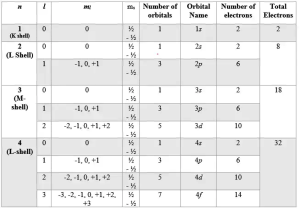
কোয়ান্টাম সংখ্যা কি সেটা জানার জন্য প্রথমেই প্রধান কোয়ান্টাম সংখ্যাকে নিয়ে জানতে হবে। বোর পরমাণু মডেল অনুসারে পরমাণুর ইলেকট্রনসমূহ নিউক্লিয়াসকে কেন্দ্র করে নির্দিষ্ট বৃত্তাকার অরবিট বা শক্তিস্তরে আবর্তন করে। পরমাণুতে ইলেকট্রনসমূহের অরবিট বা প্রধান শক্তিস্তরসমূহের ক্রমিক সংখ্যাকে প্রধান কোয়ান্টাম সংখ্যা বলা হয়। প্রধান কোয়ান্টাম সংখ্যা অরবিট বা শক্তিস্তরের আকার প্রকাশ করে। প্রধান কোয়ান্টাম সংখ্যাকে n দ্বারা প্রকাশ করা হয়। এখানে n এর মান 1, 2, 3, 4 প্রভৃতি পূর্ণ সংখ্যা। n এর মান বৃদ্ধি পাওয়ার সাথে সাথে শুধু আবর্তনশীল ইলেকটনের শক্তিই বাড়ে না, সেই সাথে নিউক্লিয়াস থেকে তার কক্ষপথের দূরত্বও বৃদ্ধি পায়। বোর মতবাদ অনুসারে, n = 1 হলে ১ম শক্তিস্তর বা K শেল। n = 2 হলে ২য় শক্তিস্তর বা L শেল, n = 3 হলে ৩য় শক্তিস্তর বা M শেল। অনুরূপভাবে ৪র্থ শক্তিস্তর বা N শেল হয়। যে কোন প্রধান শক্তিস্তরের সর্বোচ্চ ইলেকট্রন ধারণ ক্ষমতা হচ্ছে 2n2.
অ্যাজিমুথাল বা সহকারী কোয়ান্টাম সংখ্যা
পরমাণুতে ইলেকট্রন আবর্তনের জন্য প্রতিটি প্রধান শক্তিস্তর নির্দিষ্ট সংখ্যক উপশক্তিস্তরে বিভক্ত থাকে। একটি ইলেকট্রন প্রধান শক্তিস্তরের যে উপস্তরে রয়েছে তা প্রকাশের জন্য যে কোয়ান্টাম সংখ্যা ব্যবহৃত হয়, তাকে সহকারী কোয়ান্টাম সংখ্যা বলা হয়। এটিকে অরবিটাল কোয়ান্টাম সংখ্যাও বলে। সহকারী কোয়ান্টাম সংখ্যাকে l দ্বারা প্রকাশ করা হয়। l এর মান 0 থেকে (n-1) পর্যন্ত হয়। l এর মান দ্বারা উপশক্তিস্তরের আকৃতি নির্ধারিত হয়। l এর মান 0, 1, 2, 3 হলে উপশক্তিস্তরকে যথাক্রমে s, p, d, f দ্বারা চিহ্নিত করা হয়। এসব উপশক্তিস্তরে থাকা বর্তমান ইলেকট্রনগুলোকে s, p, d, f ইলেকট্রন বলা হয়। প্রধান কোয়ান্টাম সংখ্যা n এবং সহকারী কোয়ান্টাম সংখ্যা l এর মানের উপর নির্ভর করে নিম্নোক্ত উপশক্তিস্তর বা অরবিটাল পরমাণুতে থাকে।
প্রধান শক্তিস্তর, n =1 হলে, l = 0
অর্থাৎ ১ম শক্তিস্তরে উপশক্তিস্তর ১টি – 1s
প্রধান শক্তিস্তর, n = 2 হলে, l = 0, 1
অর্থাৎ ২য় শক্তিস্তরে উপশক্তিস্তর ২টি- 2s, 2p
প্রধান শক্তিস্তর, n = 3 হলে, l = 0,1, 2
অর্থাৎ ৩য় শক্তিস্তরে উপশক্তিস্তর ৩টি – 3s, 3p, 3d
প্রধান শক্তিস্তর, n = 4 হলে, l = 0, 1, 2, 3
অর্থাৎ ৪র্থ শক্তিস্তরে উপশক্তিস্তর ৪টি – 4s 4p 4d 4f
অতএব n এর মান যত, উপশক্তিস্তরের সংখ্যাও তত। যে কোন উপশক্তিস্তরের সর্বোচ্চ ইলেকট্রন ধারণক্ষমতা 2(2l + 1) এখানে l = 0 থেকে 1, 2, 3… ইত্যাদি।
উপশক্তিস্তরের নামকরণের উৎস
গ্রুপ 1 কিংবা IA এর ক্ষার ধাতুসমূহের পারমাণবিক বর্ণালীসমূহে চার শ্রেণীর বর্ণালী দেখা যায়। বিজ্ঞানীরা প্রাথমিক অবস্থায় তাদেরকে তীক্ষ্ণ বা sharp (s), প্রধান বা principal (p), পরিব্যাপ্ত বা diffused (d) ও মৌলিক বা fundamental (f) নামকরণ করে যথাক্রমে s, p, d ও f প্রতীক দ্বারা চিহ্নিত করেন এবং তাদের জন্য l এর মান যথাক্রমে 0,1,2,3 নির্দিষ্ট করা হয়। বিজ্ঞানী সমারফিল্ড পরমাণুতে ইলেকট্রনসমূহের জন্য বোর প্রস্তাবিত প্রধান শক্তিস্তরের মধ্যে বৃত্তাকার ও উপবৃত্তাকার প্রভৃতি উপশক্তিস্তরের ধারণা প্রস্তাব করেন।
চৌম্বকীয় কোয়ান্টাম সংখ্যা
পরমাণুর কেন্দ্রে ধনাত্মক চার্জযুক্ত নিউক্লিয়াস ও কক্ষপথে ঋণাত্মক চার্জযুক্ত ইলেকট্রন থাকার কারণে পরমাণুর ভেতরে একটি বিদ্যুৎ ক্ষেত্র এবং এর প্রভাবে চৌম্বক ক্ষেত্র সৃষ্টি হয়। এই চৌম্বক ক্ষেত্রের প্রভাবে ইলেকট্রনের বিভিন্ন অরবিটালের ত্রিমাত্রিক দিক স্থিতি বা অরিয়েন্টেশন (Orientation) ঘটে। পরমাণুর অরবিটালের ত্রিমাত্রিক দিকস্থিতি প্রকাশ করার জন্য যে সংখ্যা ব্যবহৃত হয়, একে চৌম্বকীয় কোয়ান্টাম সংখ্যা বলা হয়। একে m দ্বারা প্রকাশ করা হয়। m এর মান l এর উপর নির্ভরশীল এবং তা -l হতে 0 সহ +l পর্যন্ত হতে পারে। প্রতি l এর যেকোন মানের জন্য m-এর (2l + 1) সংখ্যক মান আছে। এ কোয়ান্টাম সংখ্যা দ্বারা অরবিটালের দিক নির্দেশ করা হয়। m এর মোট মান দ্বারা উপশক্তিস্তরে মোট অরবিটাল সংখ্যা বোঝায়। উপস্তরে অরবিটাল সংখ্যা নির্দেশকারী-
- উপশক্তিস্তর, s এর জন্য l = 0, m = 0
- উপশক্তিস্তর, p এর জন্য l = 1, m = 1, 0, -1
- উপশক্তিস্তর, d এর জন্য l = 2, m = 2, 1, 0, -1, -2
- উপশক্তিস্তর, f এর জন্য l = 3, m = 3, 2, 1, 0, -1, -2, -3
অর্থাৎ, s উপশক্তিস্তরে ১টি অরবিটাল, p উপশক্তিস্তরে ৩টি অরবিটাল, d উপশক্তিস্তরে ৫টি অরবিটাল, f উপশক্তিস্তরে ৭টি অরবিটাল কাজ করে।
উল্লেখ্য একই উপশক্তিস্তরের যেসব অরবিটালের শক্তি অভিন্ন হয়, তাদেরকে degenerate অরবিটাল বলা হয় এবং যে সব অরবিটালের শক্তি ভিন্ন হয়, তাদেরকে non-degenerate অরবিটাল বলা হয়। পরীক্ষা দ্বারা জানা যায় যে, উপশক্তিস্তরে আবর্তনশীল প্রতিটি ইলেকট্রনের চৌম্বক ক্ষেত্র থাকে। এরূপ কোন পরমাণুকে বাহ্যিক চৌম্বক ক্ষেত্রের প্রভাবে রাখলে পরমাণুর সমশক্তির অরবিটাল বা degenerate অরবিটালসমূহ non-degenerate অরবিটাল বা অসমশক্তির অরবিটালে পরিণত হয়, কারণ ঐ সব অরবিটালের কিছু অরবিটাল চৌম্বক ক্ষেত্রের সমান্তরাল ও অবশিষ্ট ভিন্ন থাকে। ফলে ইলেকট্রনসমূহ এক অরবিটাল থেকে ভিন্ন অরবিটালসমূহে উদ্দীপিত অবস্থায় থাকে। তখন চুম্বক ক্ষেত্রের প্রভাবে পারমাণবিক বর্ণালীর প্রত্যেক রেখা কয়েকটি বিজোড় সংখ্যক (যেমন 1, 3, 5 ইত্যাদি) সূক্ষ্ম লাইনে বিভক্ত হয়ে পড়ে। এটি বিজ্ঞানী জিম্যান (P. Zeemen) আবিষ্কার করেন বলে তাঁর নামানুসারে একে জিম্যান প্রভাব (Zeemen effect) বলা হয়।
ঘূর্ণন কোয়ান্টাম সংখ্যা
প্রতিটি ইলেকট্রনের সর্বদা নিজ অক্ষের চারদিকে ঘূর্ণন বা স্পিন গতি থাকে। অক্ষ বরাবর ঘুরতে ঘুরতে প্রতিটি ইলেকট্রন নিজের কক্ষপথে আবর্তন করে থাকে। ঘূর্ণন বা স্পিন গতির কারণে প্রতিটি ইলেকট্রন একটি অতি ক্ষুদ্র চু্ম্বকরূপে মৃদু চৌম্বক ক্ষেত্র সৃষ্টি করে।
ইলেকট্রনের স্পিন বর্ণনার জন্য যে কোয়ান্টাম সংখ্যা ব্যবহৃত হয় তাকে স্পিন কোয়ান্টাম সংখ্যা বলে। এর প্রতীক বা ms. ইলেকট্রনের ঘূর্ণনের দিক ঘড়ির কাঁটার আবর্তনের দিকে অথবা বিপরীত দিকে হতে পারে। তাই এই দুই রকম ঘূর্ণনের জন্য এই কোয়ান্টাম সংখ্যার মান দুই রকম হয় যেমন +½ অথবা -½. ms এর মানের উপর ইলেকট্রনের শক্তি কিছুটা নির্ভরশীল। সাধারণ নিয়ম হল প্রতিটি অরবিটালে বিপরীত স্পিনের মানযুক্ত দুটি ইলেকট্রন আবর্তন করতে পারে।
কোয়ান্টাম সংখ্যা কি সেটা নিয়ে সংক্ষেপে বলা যায়, প্রধান কোয়ান্টাম সংখ্যা কক্ষপথের আকার (অর্থাৎ কেন্দ্র হতে তার দূরত্ব), সহকারী কোয়ান্টাম সংখ্যা উপকক্ষপথের আকৃতি, চৌম্বকীয় কোয়ান্টাম সংখ্যা অরবিটালের কৌণিক অবস্থানের দিক ও স্পিন কোয়ান্টাম সংখ্যা ইলেকট্রনের ঘূর্ণনের দিক নির্দেশ করে। কক্ষপথভিত্তিক কোয়ান্টাম সংখ্যা হল ৩টি। বিভিন্ন কোয়ান্টাম সংখ্যার মান থেকে পরমাণুতে বিভিন্ন শক্তিস্তরে অবস্থানকারী সর্বাধিক ইলেকট্রনের সংখ্যা ও বিন্যাসের প্রকরণ নিম্নের সারণিতে দেখানো হল-